В начале января ученые из Института исследований старения Бака изучили клеточный путь нематодного червя, имеющего часть генома человека, и продлили ему жизнь в пять раз.
Изменения механизма старения клеток — один из подходов по борьбе со старением всего организма человека. Многие ведущие геронтологи мира уже продемонстрировали возможности новых методов на животных и сейчас начинают клинические испытания на людях. Другие только приступили к разработке перспективных способов.
«Хайтек» рассказывает о новых методах борьбы со старением.
В начале января ученые из Института исследований старения Бака изучили клеточный путь нематодного червя, имеющего часть генома человека, и продлили ему жизнь в пять раз. Изменения механизма старения клеток — один из подходов по борьбе со старением всего организма человека. Многие ведущие геронтологи мира уже продемонстрировали возможности новых методов на животных и сейчас начинают клинические испытания на людях. Другие только приступили к разработке перспективных способов. «Хайтек» рассказывает о новых методах борьбы со старением.
Замедление структурного разрушения кожи и предотвращение развития связанных с возрастом заболеваний — области научного интереса, оказывающие широкое влияние на здоровье человека и медицину. Большинство исследований по борьбе со старением было сосредоточено на понимании и поиске способов манипулирования метаболическими путями, которые ответственны за биологическое старение органов и клеток.
В 1998 году группа исследователей во главе с доктором Майклом Уэстом выделила активный компонент клеточных линий HeLa и 293 — теломеразу, делающую клетки человека фактически бессмертными. Эксперименты с клетками кожи в чашке Петри показали, что теломераза действительно воздействует на них как «эликсир бессмертия».
Теломераза человека — фермент, обеспечивающий бессмертие клеток, в том числе опухолевых. Теломеры, области на концах хромосом, состоящие из повторяющихся последовательностей, представляют собой «запасную» ДНК. Длина теломер ограничивает число клеточных делений определенным значением — пределом Хейфлика. Теломераза поддерживает длину теломер в «бессмертных» клеточных линиях, к которым относятся стволовые и раковые клетки, на постоянном уровне.
Спустя 20 лет в медицине появилась новое направление — геронтология. Большинство ученых, изучающих старение, теперь озабочены больше продлением «периода здоровья», чем продолжительности жизни людей в целом. Средства борьбы со старением помогут людям достигать преклонного возраста с меньшим количеством боли и болезней, а значит, и с лучшим качеством жизни.
Если ученым удастся сделать это, продление «периода здоровья» будет полезно не только для пожилых людей, но и для экономики стран в условиях старения населения во всем мире.
В мире первое место по продолжительности жизни занимает Гонконг (84,1 года), за ним следуют Япония (83,9), Швейцария (83,5), Испания (83,3) и Италия (83,2).
Почему люди стареют?
Одна из главных причин возрастных изменений, в том числе и болезней — старение клеток. Фактически это следствие эволюции нашего организма, состояние, наступающее, когда человек переживает свой нормальный репродуктивный возраст или подвергается воздействию разрушительной внешней среды. Когда клетка стареет, она теряет способность делиться и разрушает ткани вокруг себя.
В течение многих лет большая часть геронтологического сообщества считала старение клеток скорее симптомом возрастных изменений, чем их причиной.
Однако исследование, проведенное в 2016 году сотрудниками Медицинского колледжа клиники Майо, показало, что удаление стареющих клеток у мышей не только предотвращает нормальный процесс старения, но и полностью устраняет симптомы возрастных болезней. Другими словами, ученые доказали, что старение клеток — причина возрастных изменений. Это значит, что лекарство, способное остановить старение клеток, потенциально существует.
Дальнейшие эксперименты на мышах показали, что удаление стареющих клеток позволяет сильно снизить вероятность инфаркта миокарда, болезни Альцгеймера и метаболической дисфункции.
Что о возрастных изменениях думает геронтолог Обри ди Грей
В 2018 году британский геронтолог Обри ди Грей подробно рассказал «Хайтеку», почему современные врачи рассматривают старение как болезнь и работают над тем, чтобы продлить период здоровья, а не продолжительность жизни. Тем не менее, ученый предсказал, что как минимум через 20 лет у человечества может появиться универсальная вакцина, способная продлить жизнь человека вплоть до тысячи лет.
Семь типов повреждений при старении по ди Грею
- мутации ядерной ДНК, приводящие к раку;
- мутации митохондриальной ДНК;
- накопление «мусора» в клетках — продуктов жизнедеятельности, выведенных из обмена;
- накопление выведенных из обмена продуктов жизнедеятельности вне клеток;
- потеря клеток;
- старение клеток в результате сокращения теломер или повреждения ДНК;
- образование внеклеточных перекрестных связей.
Сейчас задача ученых заключается в том, чтобы перенести эти результаты на людей. С другой стороны, исследователи выяснили, что в основе почти всех возрастных болезней лежит лишь несколько биологических причин. Это открытие представляет собой возможность для лечения широкого спектра заболеваний одновременно с лечением, направленным на отдельные биологические механизмы.
Какие средства для борьбы со старением проходят клинические испытания
- Сенолитики
Сенолитики — препараты, позволяющие точечно удалять из организма старые клетки, которые становятся причиной сердечно-сосудистых и глазных заболеваний, болезни Альцгеймера и артрита. Препараты, относящиеся к этому классу, в качестве мишеней используют сенсибилизирующие клетки — они накапливаются в тканях в результате старения и стресса, перестают делиться и не умирают, как обычные клетки. Этот процесс часто приводит к различным воспалениям, а сенолитики точечно убивают сенсибилизирующие клетки и вымывают их.
Существующие сенолитики направлены на борьбу с конкретными заболеваниями — возрастной дегенерацией желтого пятна, глаукомой и хронической обструктивной болезнью легких (включая эмфизему).
Чаще всего к клиническим испытаниям в качестве сенолитиков допускают препараты, уже одобренные для лечения других заболеваний. Например, Humira и Humgen от AbbVie, получившие одобрение регуляторов для борьбы с артритом и псориазом.
Другие уже получили разрешение на испытания на людях и разрабатывались прицельно для борьбы со старением — например, Eeya Regeneron и Lucentis Genetech, одобренные для облегчения симптомов возрастных заболеваний глаз.
Предварительные клинические испытания сенолитической инъекции для борьбы с остеоартрозом, проведенные в 2019 году, показали неоднозначный результат. В ходе тестирования пациентов разделили на две группы — одна получала инъекцию средней дозы препарата, другая — максимальной. У пациентов из первой группы произошло серьезное снижение болевых ощущений и повышение функции коленей, а пациенты из второй группы не заметили никаких изменений.
Так или иначе, эксперименты с сенолитиками дают надежду на появление целого ряда препаратов, способных потенциально воздействовать на разные типы стареющих клеток.
Пока большая часть исследователей экспериментирует с комбинацией лекарств от лейкемии, дазатинибом, а также кверцетином и полифенолом, содержащимися в растениях.
Например, сочетание дазатиниба и кверцетина показало улучшение здоровья и продолжительности жизни у мышей. Более того, результаты клинических испытаний этой комбинации продемонстрировали первое в истории облегчение физической дисфункции у пациентов с идиопатическим легочным фиброзом, прогрессирующим дегенеративным заболеванием легких, не имеющим в настоящее время эффективного лечения.
- Иммунодепрессанты
Другой класс препаратов, подходящих для борьбы с возрастными изменениями, — иммунодепрессанты, это лекарства, используемые для искусственного угнетения иммунитета. Их применяют, например, при трансплантации органов — чтобы предотвратить отторжение иммунной системой реципиента.
Среди них есть рапамицин — препарат, изначально применяемый в качестве антибиотика. Дальнейшие исследования показали, что он относится к классу иммунодепрессантов. Сейчас рассматривается в качестве «лекарства от старости». При попадании в организм препарат блокирует белковый комплекс TOR, отвечающий за рост и размножение клеток. Его блокирование позволяет замедлять естественный процесс старения клетки. В то же время рапамицин имеет сильные побочные действия (вероятность развития сахарного диабета, микозных, вирусных, бактериальных заболеваний, гепатотоксичность и другие), из-за чего он до сих пор не испытывался на людях.
В ходе первых клинических испытаний исследователи использовали рапамициновый крем с небольшой концентрацией действующего вещества. Испытуемые были разделены на две группы: одной руки намазали кремом с препаратом, а другой — обычным кремом (плацебо).
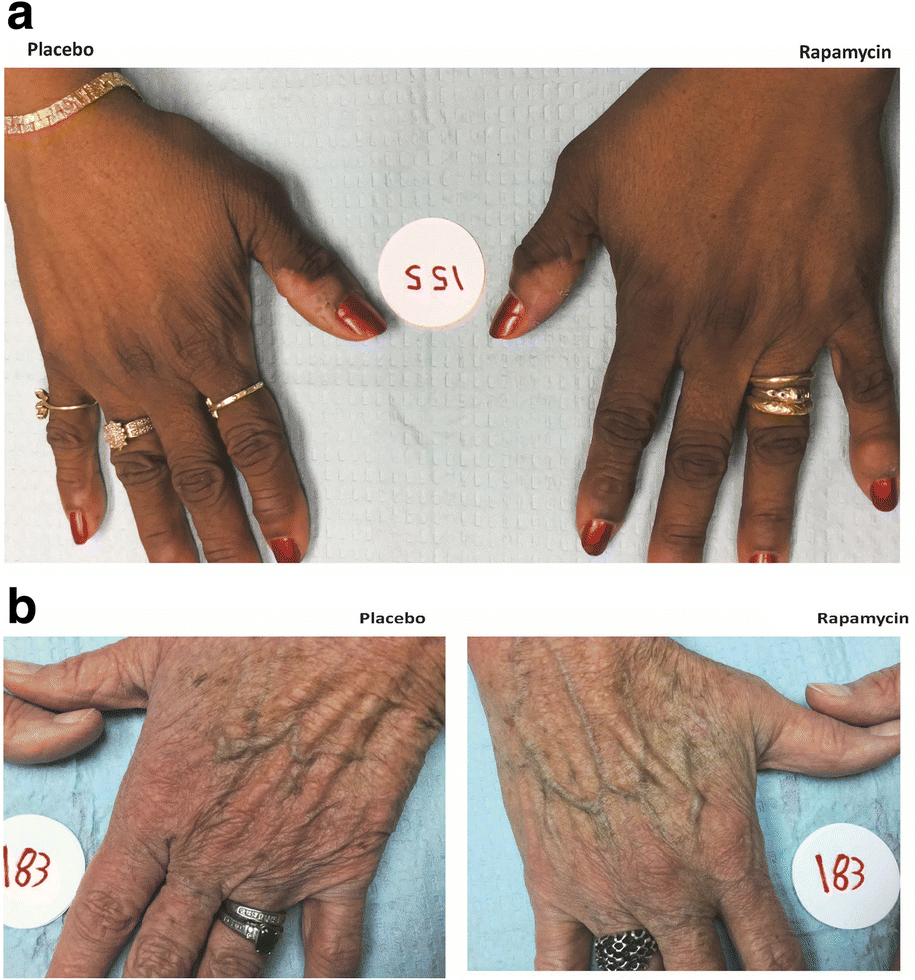
После восьми месяцев наблюдений ученые заметили, что руки испытуемых, которые получили лекарство, оказались моложе — как внешне, так и на клеточном уровне, чем руки пациентов, которые получили плацебо. При этом анализ крови показал, что рапамицина в их крови нет — как и каких-либо признаков воспалений или патологий.
Изменение клеточных путей как средство против старения
В поисках средств для борьбы со старением многие исследователи экспериментировали с нематодными червями вида Caenorhabditis elegans, которые, с одной стороны, разделяют с человеком часть генома, а с другой — имеют относительно небольшой геном, легко поддающийся фундаментальным генетическим исследованиям и изменениям. Геном C. elegans составляет приблизительно 100 млн пар оснований, тогда как геном человека состоит более чем из 3 млрд.
У C. elegans было идентифицировано более 25 генов, влияющих на продолжительность жизни, около 15 из них аналогичны генам, встречающимся у людей. Эти человеческие аналоги и представляют собой мишени для тестирования и разработки лекарств, способных предотвратить возрастные заболевания и продлить продолжительность жизни.
В ходе последнего исследования с участием C. elegans исследователи из Института исследований старения Бака добились значительных успехов — им удалось продлить жизнь червя на 500%, или в пять раз.
Обычная продолжительность жизни червей этого вида составляет 2-3 недели. В ходе эксперимента исследователи генетически изменили пути передачи (IIS) и TOR — это «законсервированные» сигналы, которые были переданы человеку в процессе эволюции. Один из них связан с инсулином (IIS), другой — с мишенью рапамицина (TOR).
Ученые внесли изменения в обе цепочки одновременно — в результате они рассчитывали на небольшое улучшение показателей, IIS должен был увеличить продолжительность жизни червя на 100%, а TOR — еще на 30%. Однако результат превзошел самые смелые прогнозы: взаимное влияние молекулярных путей позволило увеличить продолжительность жизни нематод на 500%, что эквивалентно человеческим 400 годам.
Исследователи считают, что в будущем изменение тех же клеточных путей может привести к существенному увеличению продолжительности человеческой жизни. Однако до проведения клинических испытаний новому методу пока очень далеко.
Вместе с тем, результаты исследования показали, что старение не является результатом работы какого-то одного гена — другими словами, найти конкретный ген «долголетия» не удастся, поскольку его с высокой вероятностью не существует. Продолжительность жизни у каждого организма зависит от целой сети сигнальных путей и их взаимодействия.








